Полное меню
- Актуальное
законодательство - Интернет
и право- - Рассылка ''Закон есть закон''
- - Форум сайта (архив)
- - Законодательство
- - Судебная практика (необычная)
- - Судебная практика (авторская)
- - Процедура UDRP и и решения WIPO
- - Книги серии ''Интернет и Право''
- - Книги в открытом доступе
- - Учебный курс ''Интернет и Право''
- - Учебный курс ''Доменные споры''
- - Литература по ''Интернет и Право''
- - Литература по интел. собственности
- - Научный уголок (работы гостей)
- - Авторские публикации
- Информационные
материалы - ЮРИДИЧЕСКИЕ
УСЛУГИ- - Перечень юридических услуг
- - Карта юридических услуг
- - Юридическая консультация
- - Доменные споры (RU), авторское право
- - Международный суд по доменам (COM)
- - Защита прав на маркетплейсе (WB, Ozon)
- - Защита прав в соцсетях (Vk, Ok, FB)
- - Купля-продажа домена, сайта, ПО
- - Досудебное урегулирование конфликта
- - Защита чести и деловой репутации
- - Отмена блокировки сайта/домена РКН
- - ФАС: товарные знаки, авторское право
- - Регистрация ПО/сайта (Роспатент)
- - Юридическая проверка домена
- - Нотариальное заверение сайтов
- - Способы и формы оплаты услуг
- - Мы в СМИ
- - О компании, клиенты
- - Наши дела и победы
- - Контакты и реквизиты
- Информация
о сайте -




Основные ссылки |
Вернуться в "Каталог СНиП"ГОСТ Р ИСО 16702-2008 Качество воздуха рабочей зоны. Определение общего содержания изоцианатных групп органических соединений в воздухе методом жидкостной хроматографии с использованием 1-(2-метоксифенил)пиперазина.
КАЧЕСТВО ВОЗДУХА РАБОЧЕЙ ЗОНЫ Определение
общего содержания изоцианатных групп органических соединений в ISO 16702:2007
Предисловие Цели и принципы стандартизации в
Российской Федерации установлены Федеральным законом от 27 декабря Сведения о стандарте 1 ПОДГОТОВЛЕН Автономной некоммерческой организацией «Научно-исследовательский центр контроля и диагностики технических систем» (АНО «НИЦ КД») на основе собственного аутентичного перевода стандарта, указанного в пункте 4 2 ВНЕСЕН Техническим комитетом по стандартизации ТК 457 «Качество воздуха» 3 УТВЕРЖДЕН И ВВЕДЕН
В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и
метрологии от 18 декабря 4 Настоящий стандарт идентичен международному стандарту ИСО 16702:2007 «Качество воздуха рабочей зоны. Определение общего содержания изоцианатных групп органических соединений в воздухе методом жидкостной хроматографии с использованием 1-(2-метокси-фенил)пиперазина» (ISO 16702:2007 «Workplace air quality - Determination of total organic isocyanate groups in air using 1-(2-methoxyphenyl)piperazine and liquid chromatography»). При применении настоящего стандарта рекомендуется использовать вместо ссылочных международных стандартов соответствующие им национальные стандарты Российской Федерации, сведения о которых приведены в дополнительном приложении Е 5 ВВЕДЕН ВПЕРВЫЕ Информация об изменениях к настоящему стандарту публикуется в ежегодно издаваемом информационном указателе «Национальные стандарты», а текст изменений и поправок - в ежемесячно издаваемых информационных указателях «Национальные стандарты». В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячно издаваемом информационном указателе «Национальные стандарты». Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет Содержание Введение Изоцианаты (молекулы которых содержат функциональные группы NCO), представляющие собой соединения с высокой реакционной способностью, используют при производстве красок, полиуретановых пен, пластика и клеев. Будучи известными сенсибилизаторами дыхательных путей, они являются основной причиной астмы, приобретаемой в результате использования химических соединений в профессиональной деятельности. Изоцианаты могут оказывать воздействие как при вдыхании, так и возможном контакте с ними. В Австралии, Ирландии и Объединенном Королевстве для воздуха рабочей зоны установлены допустимые уровни профессионального воздействия 1): долгосрочный (средневзвешенный для периода 8 ч) - 20 мкг/м3 [общее содержание изоцианатных NCO-групп], краткосрочный (средневзвешенный для периода 15 мин) - 70 мкг/м3. Для воздуха рабочей зоны установлены допустимые уровни профессионального воздействия: в Финляндии краткосрочный (средневзвешенный для периода 15 мин) - 35 мкг/м3, а в Швеции долгосрочный (средневзвешенный для периода 8 ч) - 5 ppb 2) [общее содержание изоцианатных NCO-групп] и краткосрочный (средневзвешенный для периода 15 мин) - 10 млрд-1. Эти ПДК установлены для общего содержания мономерных и всех полимерных изоцианатов (также называемых олигомерными изоцианатами, полиизоцианатами, олигоизоцианатами или форполимерами изоцианатов). Отбор проб и их анализ на содержание изоцианатов в виде взвешенных в воздухе частиц является непростым. Изоцианаты присутствуют в виде различных химических форм, таких как мономеры, олигомеры, полимеры, имеющие более сложную структуру, а также в виде смесей всех этих форм. Олигомеры и полимеры изоцианатов широко используют в промышленности, т.к. они менее летучие, чем мономеры, и поэтому представляют меньшую опасность. Изоцианаты встречаются в разнообразных физических состояниях, например, в виде паров, аэрозолей и жидкостей. Метод отбора проб, который подходит для определения содержания изоцианатов в одном агрегатном состоянии, может оказаться непригодным для изоцианатов в другом агрегатном состоянии. В воздухе рабочей зоны в зависимости от производимого продукта и производственного процесса также присутствуют другие вещества, такие как пары воды, пыль, амины и спирты, которые могут оказывать мешающее влияние при анализе методом жидкостной хроматографии (ЖХ). Стандартные образцы полимерных изоцианатов недоступны, хотя для получения общего содержания изоцианатов в воздухе содержание этих соединений необходимо определять количественно. Из-за высокой реакционной способности изоцианатных групп анализ на их содержание в воздухе рабочей зоны обычно проводят улавливанием изоцианатов с помощью дериватизирующего реагента, превращающего их в стабильные производные. Метод, установленный настоящим стандартом, основан на методе определения изоцианатов, принятом в Объединенном Королевстве MDHS3) 25/3 [1]. В этом методе изоцианаты улавливаются за счет образования стабильного производного мочевины в результате реакции с 1-(2-метоксифенил)пиперазином (MP). Содержание производного мочевины анализируют методом ЖХ с использованием электрохимического детектора (ЭХД) и ультрафиолетового детектора в видимой области (УВИД). Изоцианаты, стандартные образцы которых существуют или могут быть приготовлены, определяют количественно с использованием УВИД. Применение УВИД детектора предпочтительно, поскольку он более стабилен, чем ЭХД. Однако для большинства используемых в промышленности полимерных изоцианатов не существует стандартных образцов, и содержание этих соединений определяют количественно с использованием ЭХД, в котором происходит окисление метокси-группы MP. Поскольку эта группа одинакова для всех МР-производных изоцианатов, то градуировку для полимерных соединений можно проводить с использованием соответствующего изоцианатного мономера. Процедура, которой следуют при отборе проб на содержание изоцианатов в воздухе рабочей зоны, зависит от их агрегатного состояния. Было доказано, что фильтры эффективно улавливают пары. Комбинацию импинжер/фильтр рекомендуется использовать при отборе проб аэрозолей. Данный метод был признан подходящим для определения распространенных моно- и диизоцианатов, таких как метиленбис(фенилизоцианат) (MDI), фенилизоцианат (PI), толуол-2,6-диизоцианат и толуол-2,4-диизоцианат (TDI), 1,6-(диизоцианато)гексан (HDI), изофорондиизоцианат (IPDI), нафтилдиизоцианат (NDI), метиленбис(циклогексилизоцианат) (гидрированный MDI), бутилизоцианат, а также полимерных изоцианатов на основе этих мономеров. 1) Допустимым уровням профессионального воздействия в Российской Федерации соответствуют предельно допустимые концентрации (ПДК), долгосрочному - среднесменная ПДК, краткосрочному - максимально разовая ПДК. 2) В Российской Федерации единицы ppb эквивалентны млрд-1. 3) MDHS - Methods for the Determination of Hazardous Substances (Методы определения опасных веществ). НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
Дата введения - 2009-12-01 1 Область примененияНастоящий стандарт устанавливает общие положения по отбору и анализу проб на содержание органических изоцианатов (соединений содержащих NCO-группы), присутствующих в виде взвешенных частиц в воздухе рабочей зоны. Настоящий стандарт применяют для определения разнообразных органических соединений, содержащих функциональные изоцианатные группы, в том числе изоцианатных мономеров и форполимеров. Примерами ароматических мономеров являются диизоцианат толуола (TDI) (2,4- и 2,6-диизоцианатотолуол), диизоцианат нафтила (NDI) (1,5-диизоцианатонафталин) и метиленбис(4-фенили-зоцианат) [MDI, называемый по систематической номенклатуре ди-(4-изоцианатофенил)метан]. Примерами алифатических мономеров являются диизоцианат изофорона (IPDI, называемый по систематической номенклатуре 1-изоцианато-3-изоцианатометил-3,5,5-триметилциклогексан), метиленбиз(циклогексилизоцианат) (гидрированные MDI, HMDI) и 1,6-диизоцианат гексана (HDI) (также известный как 1,6-гексаметилендиизоцианат). Мономеры, содержащие одну изоцианатную группу (например, метилизоцианат, этилизоцианат, фенилизоцианат, гексилизоцианат), образуются в процессе термической деструкции полиуретанов, например, во время пламенной сварки и лазерной резки. Изоцианатные полимеры, также называемые полиизоцианатами, гомополимерами, олигомерами или форполимерами, являются производными диизоцианатных мономеров, образующимися при самоконденсации или в результате реакции с полиолами. Полимерные диизоцианаты широко используются при производстве полиуретанов, красок, покрытий и клеев. Настоящий стандарт применяют для
анализа любого продукта, содержащего свободные изоцианатные группы.
Первоначально он был разработан для определения распространенных MDI, HDI, TDI, их олигомеров и
полимеров [1].
Его также использовали при определении IPDI, HMDI, NDI, их олигомеров и
полимеров. Установленный в Объединенном Королевстве предельно допустимый
уровень профессионального воздействия (ПДК воздуха рабочей зоны) для
изоцианатов предусматривает необходимость определения общего содержания
изоцианатных групп, т.е. мономеров диизоцианатов, олигомеров, форполимеров и
полимеров диизоцианатов, а также моноизоцианатов. Поскольку изоцианаты имеют
разнообразную структуру и различные молярные массы, условия хроматографирования
необходимо изменять в соответствии с формулой определяемого изоцианата. Если
ожидается присутствие изоцианатов и аминов, и необходимо определить их
содержание, то более подходящим может быть метод, установленный другим
стандартом, позволяющий одновременно определять амины и изоцианаты [2].
Этот метод был модифицирован таким образом, что он позволяет определять
содержание моноизоцианатов, образующихся при термической деструкции [3],
использовать масс-спектрометрический детектор [4]
и другие устройства отбора проб, например, фильтры диаметром Метод, приведенный в стандарте, используют для определения средневзвешенного по времени содержания органических изоцианатов в воздухе рабочей зоны при продолжительности отбора проб от 0,5 мин до 8 ч. Метод разработан для индивидуального мониторинга качества воздуха (в зоне дыхания), но после соответствующей модификации может также быть использован для мониторинга качества воздуха в заданном месте. Примечание - Целью мониторинга воздуха обычно является определение качества вдыхаемого работником воздуха, поэтому описанные в настоящем стандарте методики предназначены для индивидуального отбора пробы в зоне дыхания. Эти методики также можно использовать для отбора проб в заданном месте или определения фонового содержания. Однако следует учитывать, что из-за аэродинамических эффектов устройства отбора проб, предназначенные для индивидуального отбора проб, не обязательно имеют такие же характеристики сбора определяемых веществ при использовании для других целей. Метод применяют для определения
находящихся в воздухе органических изоцианатов с массовой концентрацией в
диапазоне приблизительно от 0,1 до 140 мкг/м3 при объеме пробы 2 Нормативные ссылкиВ настоящем стандарте использованы нормативные ссылки на следующие международные стандарты: ИСО 5725-2:1994 Точность (правильность и прецизионность) методов и результатов измерений. Часть 2. Основной метод определения повторяемости и воспроизводимости стандартного метода измерений ЕН 1232 Воздух рабочей зоны. Насосы для отбора проб химических веществ в зоне дыхания. Требования и методы испытаний 3 Термины и определенияВ настоящем стандарте применены следующие термины с соответствующими определениями: 3.1 Химические соединения изоцианатов 3.1.1 изоцианат (isocyanate): Химическое соединение с одной или более изоцианатной (содержащей азот, углерод, кислород) функциональной группой. 3.1.2 мономер (monomer): Химическое соединение, которое при взаимодействии с другими идентичными соединениями образует димеры, тримеры, олигомеры или полимеры. Пример - Изоцианатные мономеры подразделяют на следующие классы: моноизоцианаты, содержащие одну изоцианатную функциональную группу, например, метилизоцианат; диизоцианаты, например, ди(4-изоцианатофенил)метан (MDI); триизоцианаты, например, три(4-изоцианатофенил)метан. 3.1.3 диизоцианат (diisocyanate): Химическое соединение с двумя функциональными изоцианатными группами. 3.1.4 олигомер (oligomer): Соединение с низкой относительной молекулярной массой, с повторяющимися изоцианатными функциональными группами, образовавшееся при взаимодействии изоцианатных мономеров. 3.1.5 полиизоцианат, олиго-изоцианат (piolyisocyanate, oligo-isocyanate): Изоцианатное соединение с множественными изоцианатными функциональными группами. 3.1.6 форполимер (изоцианатов) (prepolymer): Заканчивающийся изоцианатом продукт реакции ди- или полиизоцианатов с полиолами, содержащими концевые гидроксильные группы в стехиометрическом недостатке; эти соединения затем вступают в реакции с образованием полиуретанов или подобных соединений. 3.2 Аналитические термины 3.2.1 средневзвешенное по времени содержание (time-weighted average concentration): Содержание химического соединения в воздухе, усредненное за регламентированный период. 3.2.2 холостая проба для условий применения (field blank): Часть устройства отбора проб (фильтр или импинжер), с которой обращаются так же, как и с аналогичной частью устройства отбора реальных проб, за исключением самого процесса отбора проб, т.е. ее устанавливают в устройство отбора проб, транспортируемое к месту отбора проб, получают производные для пробы так же как и производные для реальных проб, и анализируют вместе с реальными пробами. 3.3 Статистический термин 3.3.1 неопределенность <измерения> (uncertainty <of measurement>): Параметр, связанный с результатом измерения, характеризующий дисперсию значений, которые могут быть обоснованно приписаны измеряемой величине. [Руководство ИСО/МЭК 98:1995 [5], статья 2.2.3]. Примечания 1 В качестве параметра может быть, например, стандартное отклонение (или кратное ему) или ширина доверительного интервала. 2 Неопределенность измерения обычно включает много составляющих. Некоторые из этих составляющих могут быть оценены из статистического распределения результатов рядов измерений и могут характеризоваться стандартными отклонениями. Другие составляющие, которые также могут характеризоваться стандартными отклонениями, оценивают из предполагаемых распределений вероятностей, основанных на опыте или другой информации. Данные два случая часто рассматриваются как оценка неопределенности по типу А и типу В, соответственно. 4 Основные положенияВыбор устройства отбора проб зависит от агрегатного состояния отбираемого изоцианата. При отборе проб аэрозолей изоцианатов используют стеклянный импинжер, содержащий раствор 1-(2-метокси-фенил)пиперазина (MP) в комбинации с фильтром, пропитанным раствором реактива MP. При отборе паров изоцианатов возможно использование только фильтра, пропитанного раствором MP. Определенный объем воздуха прокачивают через стеклянный импинжер, содержащий раствор 1-(2-метоксифенил)пиперазина (MP), затем через фильтр, пропитанный раствором реактива MP (аэрозоли изоцианатов), или только через фильтр, пропитанный раствором реактива MP (пары изоцианатов). Любые органические изоцианаты, присутствующие в воздухе, будут вступать в реакцию с образованием нелетучих производных мочевины. Образовавшийся раствор концентрируют и анализируют методом высокоэффективной жидкостной хроматографии (ВЭЖХ) с использованием УВИД 1) и ЭХД. Пики производных изоцианатов идентифицируют путем сравнения откликов ЭХД и УВИД с откликами, полученными с помощью детекторов на основе диодной матрицы (ДДМ) и сопоставленных с библиотечными спектрами, или с помощью масс-спектрометрического детектирования (если возможно) для первичной пробы [6]. Количественное определение изоцианатов, для которых имеются стандартные образцы MP-производных, например изомеров HDI, MDI, TDI, можно проводить с использованием УВИД. Если подходящие стандартные образцы отсутствуют, например, как в случае изоцианатных олигомеров, форполимеров и полимеров, то их количественное определение проводят при помощи ЭХД с использованием для градуировки стандартного образца соответствующего изоцианатного мономера. Общее содержание изоцианатов в воздухе вычисляют по сумме всех пиков производных изоцианатов. 1) По усмотрению пользователя вместо УВИД может быть использован ультрафиолетовый детектор (УФД). 5 Реактивы и материалыВо время анализа используют только реактивы, имеющие соответствующий класс чистый для анализа, и только дистиллированную воду или воду эквивалентной чистоты. 5.1 Реактив MP [1-(2-метоксифенил)пиперазин] Реактив выпускается серийно с массовой долей основного компонента (далее - чистотой) не менее 98 %. 5.2 Растворитель
5.3 Растворы реактивов Точно взвешенную навеску,
приблизительно 50 мг MP, переносят в сухую мерную колбу вместимостью 100 мл. Навеску
растворяют, доводят растворителем объем раствора до метки и тщательно
перемешивают. В другую мерную колбу переносят 10 мл этого исходного раствора и
доводят растворителем его объем до 100 мл для получения раствора, поглощающего
на длине волны 260 мкм. 5.3.2 Приготовление раствора для пропитки фильтров (раствор А) Точно взвешенную навеску,
приблизительно 5.3.3 Стабильность
растворов реактивов Свежие растворы готовят еженедельно. 5.4 Градуировочные стандартные образцы 5.4.1 Приготовление
производных мономеров Добавляют 1) Пример
серийно выпускаемой продукции. Данная информация приведена для удобства
пользователей настоящего стандарта и не является рекламой данной продукции со
стороны ИСО. 5.4.2 Альтернативная
методика для малорастворимых производных изоцианатов MDI и HMDI практически не
растворимы в толуоле, и для этих соединений более подходящим является метод
приготовления, приведенный ниже. Медленно добавляют раствор соответствующего
изоцианата ( Примечание - Эту методику также можно использовать для изоциантных олигомеров,
полимеров и форполимеров. 5.4.3
Приготовление стандартных растворов на основе перекристаллизованных производных
изоциантных монометров 5.4.3.1 Навеску производного мочевины известной
массы помещают в мерную колбу вместимостью 100 мл, доводят объем раствора до
метки ацетонитрилом или метанолом. Аликвоты полученного раствора разбавляют по
объему ацетонитрилом или подвижной фазой ВЭЖХ для получения ряда стандартных
растворов с массовой концентрацией в пересчете на NCO в диапазоне
значений от 0,01 до 1,0 мкг/мл. 5.4.3.2 Готовят дополнительные стандартные растворы,
если диапазон значений массовой концентрации аналитов в пробах выходит за
пределы диапазона значений массовой концентрации стандартных растворов. 5.4.3.3 Массовую концентрацию изоцианата в
стандартном растворе ρNCO, мкг/мл, вычисляют по формуле (1) где ρU - массовая
концентрация производного мочевины в стандартном растворе, мкг/мл; MNCO - относительная
молекулярная масса NCO-группы; n - число изоцианатных групп в молекуле; MU - относительная молекулярная масса производного
мочевины. 5.5 Стабильность
изоцианатных производных мочевины и их растворов Было установлено, что исходные
растворы производных изоцианатных мономеров остаются стабильными в течение
приблизительно шести месяцев при условии хранения в морозильной камере [7].
Смесь 2,4-TDI и 2,6-TDI на фильтрах и в
растворе толуола остается стабильной до 90 дней (эффективность ее извлечения с
фильтра составляет 73 %, из раствора толуола - 81 %) [8].
MDI на фильтрах остается стабильным в течение не менее
6 мес. [1].
Изоцианатный форполимер [Desmodur N 3390 1)], введенный шприцем на фильтры, пропитанные MP, остается стабильным в течение 27 дней (средняя
эффективность извлечения составляет (91 ± 11) %, при введении 0,1; 1 и 2 мкг на
фильтр) [9]. 1) Пример
серийно выпускаемой продукции. Данная информация приведена для удобства
пользователей настоящего стандарта и не является рекламой данной продукции со
стороны ИСО. 5.6 Подвижная фаза высокоэффективной жидкостной
хроматографии Точный состав используемой
подвижной фазы зависит от формулы определяемого изоцианата. Чем больше
ацетонитрила содержится в подвижной фазе, тем быстрее будут выходить пики.
«Медленную» подвижную фазу можно использовать для MP-производных диизоцианатных мономеров и
моноизоцианатов. Для MP-производных изоцианатных полимеров более подходящей является «быстрая»
подвижная фаза. Необходимо обеспечить, чтобы элюировались пики всех полимерных
МР-производных и чтобы ни один из индивидуальных пиков мономеров не
перекрывался пиком ацетилированного MP в начале
хроматограммы. 5.6.1 Приготовление «медленной» подвижной фазы «Медленную» подвижную фазу,
подходящую для определения мономерных диизоцианатов и моноизоцианатов, готовят
следующим образом. 5.6.2 Приготовление «быстрой» подвижной фазы «Быструю» подвижную фазу,
подходящую для определения полимерных диизоцианатов, готовят следующим образом.
5.7 Градуировочная газовоздушная смесь Газовоздушную смесь с известным
содержанием определяемых(ого) веществ(а) в воздухе готовят признанным методом.
Подходящими являются методы, установленные в ИСО 6145 (все части). Содержание
определяемого компонента в газо-воздушной смеси подтверждают с использованием
независимого метода. До начала отбора и анализа проб
проводят очистку всей стеклянной посуды, включая импинжеры (см. 8.2). Кроме обычного лабораторного
оборудования, используют следующую аппаратуру. 6.1 Устройство отбора проб Выбор устройства отбора проб
зависит от агрегатного состояния, в котором изоцианаты присутствуют в воздухе. Отбор
проб изоцианатов, находящихся в парообразном состоянии, может быть проведен с
использованием только фильтра с пропиткой. Для смесей паров и взвешенных частиц
рекомендуется использовать комбинацию импинжера и фильтра с пропиткой.
Подробное описание альтернативной методики отбора проб приведено ниже. 6.2 Фильтр Фильтры, диаметром 1) Пример
серийно выпускаемой продукции. Данная информация приведена для удобства
пользователей настоящего стандарта и не является рекламой данной продукции со
стороны ИСО. 6.3 Фильтродержатель Подробная информация по выбору
насадок для отбора проб приведена в [10].
Для фильтров с пробами используют фильтродержатели, рекомендуемые Институтами
профессиональной медицины, диаметром 1) Пример
серийно выпускаемой продукции. Данная информация приведена для удобства
пользователей настоящего стандарта и не является рекламой данной продукции со
стороны ИСО. 6.4 Миниатюрный импинжер Различные конструкции барботажных
устройств и импинжеров приведены в [11]
и [12].
Миниатюрный импинжер состоит из градуированного приемного устройства и входной
трубки конической формы. Примечание - Серийно выпускаются импинжеры «непроливашка». 6.5 Насос для отбора проб 2) Насос должен соответствовать
требованиям ЕН 1232 или эквивалентного стандарта. Насос для отбора проб должен
также соответствовать требованиям по безопасности национального
законодательства. 2) Можно
использовать насос с номинальным объемным расходом от 5 мл/мин до 5 л/мин (см.
ЕН 1232). 6.6 Шланги Шланги из пластика, резины или
другого подходящего материала, длиной около 6.7 Расходомер Расходомер, портативный, используемый
для измерения расхода с погрешностью в пределах ± 5 %, отградуированный по
рабочему эталону [10].
Расходомеры, встроенные в насосы для отбора проб, не пригодны для точного
измерения расхода. Однако, их можно использовать для контроля эффективности
устройств отбора проб при условии, что они обладают достаточной
чувствительностью. 6.8 Устройство фильтрации Фильтрующий элемент для
фильтрации растворителей для жидкостной хроматографии, изготовленный из
материала, стойкого по отношению к этому растворителю, с размером пор не более
0,5 мкм. Для фильтрации десорбированных проб перед анализом методом жидкостной
хроматографии используют фильтры или шприцы с фильтрующими насадками с размером
пор не более 0,5 мкм. 6.9 Вспомогательные устройства Ремни или перевязь, при помощи
которых насос для отбора проб может быть удобно размещен (в том случае, если
размер не позволяет поместить его в кармане рабочего). Пинцеты с плоскими губками для
переноса фильтров. Защитный кожух для импинжера. Ловушка с активированным углем
для защиты насоса для отбора проб от паров толуола (при использовании насосов
из пластика). 6.10 Жидкостный хроматограф Необходимо использовать
высокоэффективный жидкостный хроматограф (ВЭЖХ) с УВИД и ЭХД. ЭХД следует
использовать в режиме окисления. Для подтверждения идентификации также
рекомендуется использовать детектор на основе диодной матрицы. Для получения
необходимого для данного метода предела количественного определения следует
избегать флуктуации температуры. Это может быть достигнуто термостатированием
колонки ВЭЖХ и ЭХД. Характеристики ЭХД можно улучшить путем рециркуляции
подвижной фазы в закрытой петле с использованием защитной ячейки (с потенциалом
приблизительно на 50 мВ выше потенциала аналитической ячейки), установленной
перед инжектором. Использование демпфера пульсаций также позволяет снизить шумы
в системе ВЭЖХ и увеличить отношение сигнал/шум. 6.11 Автоматическое устройство отбора проб Автоматические устройства отбора
проб выпускаются серийно. Примечание - До сих пор не установлено смещение относительно друг друга для
существующих методов анализа проб на содержание изоцианатов. Насос калибруют вместе с подсоединенным
типичным импинжером и/или фильтрующим элементом с использованием
соответствующего поверенного внешнего измерительного прибора. При использовании
импинжера его следует заполнить поглощающим раствором или толуолом. При долгосрочном отборе проб
продолжительность отбора проб выбирают такой, чтобы фильтр не засорился
твердыми частицами. Примечание - Средневзвешенное за 8 ч содержание можно вычислить на основе
результатов двух или более последовательных отборов проб. Перед использованием устройства
отбора проб (кассетные фильтры и/или импинжеры) очищают. Устройства отбора проб
разбирают, замачивают в лабораторном моющем растворе, тщательно промывают
водой, вытирают при помощи впитывающей ткани, оставляют до полного высыхания
перед сборкой. Альтернативой является использование лабораторной моечной
машины. 7.4.1 Пропитка
фильтров Точно взвешенную навеску,
приблизительно 7.4.2 Подготовка
устройств для отбора проб (фильтры) В зоне, свободной от
изоцианатов, фильтры вставляют в чистые сухие устройства отбора проб при помощи
чистого пинцета с плоскими губками. Каждую насадку для отбора проб со вставленным
фильтром герметично подсоединяют к насосу для отбора проб при помощи
пластиковых соединительных трубок. Включают насос и ожидают, пока не
установится его рабочий режим, к насадке для отбора проб подсоединяют
отградуированный расходомер для измерения расхода через входную диафрагму
устройства отбора проб, устанавливают соответствующий расход с отклонением в
пределах ± 5 %. Выключают насос и герметично закрывают устройство отбора проб
защитной крышкой во избежание внесения загрязняющих веществ во время
транспортирования к месту отбора проб. В зоне, свободной от изоцианатов,
непосредственно перед отбором проб вводят 10 мл поглощающего раствора в
импинжер и собирают его. Импинжер помещают внутри защитного кожуха и
подсоединяют к насосу для отбора проб при помощи подходящих соединительных
трубок. Обеспечивают герметичность всех соединений. 7.6.1 Установка
устройств отбора проб с фильтрами В зоне, свободной от изоцианатов,
прикрепляют устройство отбора проб к лацканам одежды работника в зоне его
дыхания. Насос для отбора проб размещают в подходящем кармане или прикрепляют к
одежде работника таким образом, чтобы он не причинял неудобства (например, при
помощи поясного ремня). Перед началом отбора проб с устройства отбора проб
снимают защитную крышку и включают насос. Записывают время начала отбора проб,
а в случае, если в насос встроен индикатор времени работы, проверяют, чтобы
индикатор был установлен на ноль. 7.6.2 Отбор проб на
фильтры Определенный объем воздуха
прокачивают через устройство отбора проб с расходом 2,0 л/мин. Рекомендуемый
объем прокачиваемого воздуха составляет от 20 до 7.7.1 Обоснование
отбора проб с использованием импинжера и фильтра Для улавливания смесей взвешенных
в воздухе частиц и паров были применены как фильтры, пропитанные раствором
дериватизирующего реагента, так и импинжеры, содержащие раствор этого реагента.
Однако было установлено, что ни одна из этих систем в отдельности не
обеспечивает эффективное улавливание всех изоцианатов. Смеси взвешенных частиц
и/или паров (аэрозолей изоцианатов) улавливаются пропитанными фильтрами
неудовлетворительно, поскольку изоцианаты могут взаимодействовать с другими
соединениями как в состоянии взвешенных частиц, так и будучи уже собранными на
фильтре. Кроме этого, импинжеры не подходят для отбора проб изоцианатов с
размерами частиц наиболее характерными для воздуха рабочей зоны, т.к. частицы
диаметром менее 1 мкм улавливаются неэффективно. А изоцианаты, присутствующие в
виде крупных частиц (диаметром более 10 мкм) и уловленные пропитанными
фильтрами, могут быть неэффективно переведены в производные. Поэтому комбинация
импинжера и пропитанного фильтра должна обеспечить достаточную эффективность
улавливания, как аэрозолей, так и паров изоцианатов [13]. 7.7.2 Рекомендованный
расход при отборе проб с использованием комбинации импинжера и фильтра При отборе проб с использованием
комбинации импинжера и фильтра рекомендуется устанавливать расход 1 л/мин. При
использовании комбинации импинжера и фильтра последний должен быть установлен
после импинжера; в противном случае фильтр засорится крупными частицами, что
может привести к неэффективной дериватизации изоцианатов в производные. Таким
образом, линия отбора проб должна представлять собой последовательность
импинжер - фильтр - насос. Целью использования фильтра является дериватизация
любых мелких частиц, которые могут пройти через импинжер. В конце периода отбора проб
измеряют расход при помощи отградуированного расходомера, выключают насос,
записывают значение расхода и время. Также регистрируют показание индикатора
времени работы (при наличии) и считают пробу недействительной, если показание
индикатора времени работы и интервал времени, измеренный от момента включения
до момента выключения насоса для отбора проб, отличаются более чем на 5 %, так
как это может означать, что работа насоса была прервана в течение отбора проб.
Вычисляют средний расход путем усреднения результатов измерений расхода в ходе
отбора проб, вычисляют объем отобранного воздуха, в литрах, путем умножения
расхода, в литрах в минуту, на продолжительность отбора проб, в минутах. Устройство отбора проб герметично
закрывают при помощи защитной крышки и отсоединяют его от насоса для отбора
проб. Аккуратно записывают идентификацию пробы и всю относящуюся к пробе
информацию. Изоцианаты, присутствующие в виде крупных частиц (диаметром более
10 мкм) и уловленные пропитанными фильтрами, могут быть дериватизированы
неэффективно. По этой причине рекомендуется проводить десорбцию с фильтра
поглощающим раствором MP (см. 5.3.1)
в условиях применения непосредственно по окончании отбора проб. 7.10.1
Транспортирование фильтров с пробами Для транспортирования в
лабораторию каждый фильтр вынимают из устройства отбора проб, помещают в
стеклянную виалу размером 7.10.2 Транспортирование
импинжеров с пробами В случае отбора проб в импинжеры
содержимое каждого из них переносят в стеклянную виалу, которую герметично
закрывают завинчивающейся крышкой с прокладкой из политетрафторэтилена (ПТФЭ).
Промывают импинжер и его входную трубку небольшим объемом растворителя, смывы
переносят в виалу. Нет необходимости записывать получившийся объем раствора
либо доводить его до первоначального объема. Холостые пробы для условий
применения (см. 3.2.2)
следует получать с использованием устройств отбора проб, идентичных
устройствам, используемым для реального отбора проб и подвергать их тем же
процедурам, что и реальные пробы, за исключением самого процесса отбора проб.
Полученные пробы маркируют как холостые. ПРЕДУПРЕЖДЕНИЕ - Для снижения степени возможного
воздействия опасных растворителей и реактивов на кожу рук во время анализа
следует надевать одноразовые перчатки. В настоящем стандарте не приведены все
требования безопасности, которые следует соблюдать при его применении.
Пользователь настоящего стандарта несет ответственность за разработку
соответствующих мер безопасности и охраны здоровья с учетом требований
законодательных актов. Перед использованием всю
стеклянную посуду, в том числе устройства для отбора проб, например, импинжеры,
очищают от остатков смазки или химических веществ. Ацетилирование
непрореагировавшего реагента MP до проведения реакции
улучшает хроматографическое разделение производных изоцианатов. После
проведения отбора проб содержимое импинжера переносят в виалу с завинчивающейся
крышкой в соответствии с процедурой, описанной выше. С момента отбора проб
должно пройти не менее 24 ч для обеспечения того, чтобы изоцианатные
форполимеры прореагировали полностью. Пипеткой в виалу вводят 100 мкл уксусного
ангидрида и тщательно перемешивают. Выпаривают до сухого остатка, осадок
повторно растворяют в 2 мл ацетонитрила или подвижной фазы и переносят
полученный раствор в стеклянную виалу. Проводят анализ на ВЭЖХ, как описано
ниже. Пипеткой вводят в каждую
стеклянную виалу, содержащую поглощающий раствор MP (см. 5.3.1)
и фильтровальную бумагу, 100 мкл уксусного ангидрида и тщательно перемешивают.
Выпаривают до сухого остатка, осадок повторно растворяют в 2 мл ацетонитрила
или подвижной фазы. Фильтруют этот раствор в виалу автоматического устройства
отбора проб при помощи фильтра или фильтрующей насадки на шприц с размером пор
менее 0,5 мкм. Проводят анализ на ВЭЖХ, как описано ниже. 8.5.1 Выбор условий хроматографирования Для анализа органических
изоцианатов в растворе можно использовать различные условия
хроматографирования. Выбор условий зависит в основном от природы мешающих
веществ, которые могут оказывать влияние на процесс хроматографического
анализа, а также от природы определяемых изоцианатов. Типичные условия
следующие: - размеры колонки:
длина - заполнение колонки:
октадецилсилан (С18) с размером частиц 5 мкм или аналогичный; - температура
колонки: 20°С; - расход: 1 мл/мин; - УВИД, работающий на
длине волны 242 нм и/или детектор на основе диодной матрицы; - ЭХД: пористый
графитовый электрод, работающий при потенциале + 0,8 В. 8.5.1.1 Данные по типичному
времени удерживания, получаемые при использовании «медленной» подвижной фазы,
описанной в 5.6.1,
приведены в таблице 1. Таблица 1 - Типичное время удерживания, получаемое при
выполнении условий использования «медленной» подвижной фазы Изоцианат Время
удерживания, мин HDI 6,0 MDI 11,5 2,6-TDI 5,0 2,4-TDI 6,7 8.5.2 Оптимизация
условий анализа методом высокоэффективной жидкостной хроматографии 8.5.2.1 Пик реактива
может перекрыть пик изоцианатного мономера. Для улучшения разделения понижают содержание
ацетонитрила в подвижной фазе и перед анализом проводят ацетилирование пробы
путем добавления уксусного ангидрида, как описано в 8.3.
Если противодавление в колонке ВЭЖХ высокое, то понижают концентрацию буферного
раствора. 8.5.2.2 Для более
быстрого анализа MDI подвижную фазу модифицируют путем повышения
содержания ацетонитрила, например, в случае описанной выше системы увеличение
объемной доли ацетонитрила в подвижной фазе до 56 % приводит к снижению времени
удерживания MDI до 7,0 мин. При высоких концентрациях растворы проб
разбавляют ацетонитрилом для того, чтобы определяемое значение попадало в
пределы построенной градуировочной зависимости. Повторно проводят анализ и
записывают коэффициент разбавления. 8.5.2.3 Время
удерживания для пиков форполимеров может изменяться в зависимости от производителя
форполимера. Данные по типичному времени удерживания, получаемые при
использовании «быстрой» подвижной фазы, описанной в 5.6.2,
приведены в таблице 2. Таблица 2 - Типичное время удерживания, получаемое при
выполнении условий использования «быстрой» подвижной фазы Изоцианат Время
удерживания, мин HDI 3,0 MDI 4,5 HDI (полимеры) От 6 до 45 MDI (полимеры) От 6 до 45 Проводят предварительную
обработку проб, холостых проб для условий применения и проб, используемых для
определения эффективности отбора проб, как указано в 8.3
и 8.4.
Пробы анализируют путем введения известного фиксированного объема (от 10 до 20
мкл) каждого стандартного раствора в ВЭЖХ с УВИД, работающим на заданной длине
волны (как описано выше). Для получения воспроизводимых высот/площадей пиков
следует отработать технику введения. Строят градуировочный график зависимости
сигнала УВИД (высоты или площади пика) от массовой концентрации определяемого
компонента в стандартном растворе. Вводят один и тот же
фиксированный объем предварительно обработанного раствора пробы в ВЭЖХ.
Считывают сигнал УВИД при заданной длине волны, например 242 нм, и по градуировочному
графику определяют массовую концентрацию аналита в предварительно обработанной
пробе 1). Аналогичным образом проводят анализ холостых проб и проб,
используемых для определения эффективности отбора проб (см. приложение
А). 1)
В современных хроматографах данная операция, а также получение градуировочной
зависимости, выполняется автоматически с помощью компьютера, по аттестованной
программе. Стандартные образцы MP-производных полимерных изоцианатов трудно доступны.
Если ожидается присутствие олигомеров, полимеров или форполимеров изоцианатов,
то пики этих соединений должны быть точно идентифицированы. Рассматривают все пики на
хроматограмме ВЭЖХ и для каждого пика вычисляют отношение сигналов ЭХД и УВИД
(при заданной длине волны). Также анализируют пики на хроматограмме
стандартного образца соответствующего производного мономера изоцианата,
полученной при тех же условиях. Обычно пик мономера присутствует на
хроматограмме форполимера, но он может быть значительно меньше по сравнению с
пиками форполимеров, например, обычно в красках на основе полимера HDI, используемых при ремонте автомобилей, содержится
менее 1 % мономерного HDI. Отношение сигналов,
соответствующих высотам пиков на хроматограммах двух детекторов, вычисляют
следующим образом. Отношение высот пиков для полимера у вычисляют по формуле (2) где Epoly - высота пика,
полученного с помощью ЭХД; Upoly- высота пика,
полученного с помощью УВИД. Отношение высот пиков для мономера
х вычисляют по формуле (3) где Emono - высота пика
полученного с помощью ЭХД; Umono - высота пика, полученного с помощью УВИД. Пики, для которых отношение
сигналов у/х составляет от 0,6 до
1,7, приписывают производным изоцианатов. Для вычисления общего содержания
изоцианатов в растворе пробы измеряют сигналы ЭХД для этих пиков, определяют
соответствующие им значения содержания на градуировочном графике для
производного мономера и суммируют полученные значения. В случае некоторых форполимеров
для элюирования всех компонентов может потребоваться более 40 мин. В подобных
случаях рекомендуется модифицировать подвижную фазу после первого цикла.
Повышение содержания ацетонитрила позволит уменьшить время элюирования и
улучшить форму пиков на конечном участке хроматограммы, что позволит более
точно вычислить значения площадей пиков. Примечания 1
В идеальном случае отношение у/х должно
быть равно 1, т.е. для изоцианатных полимеров и мономеров отношение сигналов
ЭХД и УВИД должно быть одинаковым. На практике сигналы УВИД для мономеров и
полимеров отличаются. Было эмпирически доказано, что отношение у/х для изоцианатов составляет от 0,6
до 1,7 [14]. 2
Отношение сигналов детекторов зависит от типа изоцианата, а также изменяется со
временем в зависимости от состояния ЭХД. Оно также зависит от длины волны, на
которую настроен УВИД, и потенциала, установленного на ЭХД. Однако для серии
анализов, проведенных в один и тот же день, отношение сигналов детекторов для
данного изоцианатного мономера и его производных форполимеров должно оставаться
приблизительно постоянным. 3 Отношение E/U является руководством только для идентификации. Аналитик
несет ответственность за правильную идентификацию основных пиков на
хроматограмме. Примеры типичных хроматограмм, полученных с использованием ЭХД и
УВИД, приведены в приложении D. 8.8.1 Анализ
первичной пробы Дополнительно к методу вычисления
отношений, приведенному выше, возможно подтверждение присутствия полимерных
изоцианатов (форполимеров), если доступен анализ первичной пробы. При этом сравнивают
данные по времени удерживания для первичной пробы и хроматограмм проб
МР-производных соединений. Этот подход нельзя успешно применить в случае, когда
отсутствуют концевые изоцианатные группы или изоцианаты, являющиеся продуктом
горячего формования. В принципе, пики на хроматограмме пробы могут не
соответствовать пикам на хроматограмме первичной пробы, так как может произойти
некоторое изменение форполимера в воздухе, например в результате частичной
реакции с полиолами, содержащимися в воздухе. На практике дополнительные пики
не были обнаружены при рутинном анализе проб [6],
[7]
и [14].
Если в воздухе содержатся частично прореагировавшие вещества, то сигнал ЭХД на MP-производное форполимера должен быть пропорционален
числу оставшихся свободных изоцианатных групп, так как сигнал в первую очередь
является функцией присоединенных метоксифенильных групп, а не изоцианатной
матрицы. 8.8.2 Подтверждение
идентификации с использованием детектора на основе диодной матрицы Детектор на основе диодной
матрицы (ДДМ) также используют для подтверждения того, что пик относится к
изоцианату [14].
Использование ДДМ позволяет проводить сравнение времени удерживания для
реальных проб с временем удерживания для стандартных образцов производных мономеров
и первичной пробы. По чистоте пиков на спектрограмме определяют элюированные
одновременно соединения и проводят с помощью сравнения с библиотекой спектров
их идентификацию. Было определено, что изоцианатные форполимеры дают спектр на
ДДМ, практически совпадающий со спектром исходного мономера [7]
и [14].
ДДМ также позволяет использовать градиентное элюирование для уменьшения времени
анализа и улучшения формы пиков соединений с большим временем элюирования. Если
использовать градиент, с изменением содержания ацетонитрила до 100 %, то это
может удалить полимерные изоцианаты с высокой степенью полимеризации, если
ожидается их присутствие. Градиентное элюирование не применяют при
использовании ЭХД, так как на выходной сигнал ЭХД влияет состав подвижной фазы. 8.8.3 Подтверждение
идентификации с использованием других методик Для подтверждения идентификации
можно использовать другие методики. Например ВЭЖХ с масс-спектроскопическим
детектированием - для подтверждения идентификации пиков [4],
[6]
и [15].
Методы титрования или инфракрасной спектрометрии с Фурье-преобразованием могут
быть использованы для определения содержания изоцианатов в первичной пробе без
предварительной дериватизации [6],
[7]
и [9].
Другими источниками информации относительно первичных проб без предварительной
дериватизации являются паспорта безопасности веществ или информация
производителя. При рутинном анализе мономеров,
как описано выше, достаточно использовать только УВИД, так как стандартные
образцы этих соединений доступны или могут быть легко синтезированы. Однако для
большинства используемых в промышленности полимерных изоцианатов стандартных
образцов не существует. В данном методе эти соединения количественно
определяются с использованием ЭХД, в котором происходит окисление метоксильных
групп на дериватизирующем реагенте MP. Поскольку эта группа является общей для всех MP-производных изоцианатов, градуировку для образцов
полимеров можно проводить с использованием соответствующего мономерного
изоцианата [16].
После идентификации пиков производных изоцианатов, как описано в 8.7
и 8.8,
пики определяемых соединений количественно анализируют с использованием ЭХД для
соответствующего MP-производного
мономерного изоцианата, анологично приведенному в 8.6
для УВИД. Как указано во введении к настоящему стандарту, сигнал ЭХД,
используемый при количественном определении полимерных изоцианатов, является
менее устойчивым и менее линейным, чем сигнал УВИД, используемого при
количественном определении мономерных соединений. Было определено, что
использование внутреннего стандарта значительно улучшает линейность и повышает
стабильность выходного сигнала ЭХД [16]. Примечание - Количественное определение полимерных изоцианатов наряду с
мономерными является требованием законодательства Объединенного Королевства. Эффективность отбора проб Esam может быть
менее 1,0 (100 %) из-за неполноты реакции изоцианата с MP на фильтре или
в импинжере, например, если отбирают большой объем воздуха или используют
слишком высокий расход. Низкая эффективность отбора проб также имеет место,
если содержание MP в место отбора уменьшено, например, из-за наличия
крупных капель с высоким содержанием изоцианатов. Метод определения
эффективности отбора проб приведен в приложении
А. Альтернативой является использование двух последовательно
соединенных устройств отбора проб, результаты измерений по которым суммируют
для получения общего содержания изоцианатов. Обычно эффективность отбора проб
составляет от 0,95 до 1,05. Необходимо введение поправки на неполную абсорбцию,
если эффективность отбора проб в условиях применения менее 0,95. Поправки на холостой опыт и
эффективность отбора проб вводят следующим образом. Общее содержание
изоцианатов в пробе воздуха в пересчете на NCO ρsam, мкг/м3, вычисляют по формуле (4) где Df - объем
десорбированного раствора, мл; ρ - массовая
концентрация изоцианатов в пробе по градуировочной зависимости, полученной по
стандартным растворам, мкг/мл; ρblank - массовая
концентрация изоцианатов в холостой пробе, мкг/мл; Esam - эффективность отбора проб; Vsam - объем пробы воздуха, л. При необходимости массовую
концентрацию изоцианатов в отбираемом воздухе, приведенную к заданным условиям
(например, температуре 25°С и давлению 101 кПа), рс, в микрограммах
на кубический метр, вычисляют по формуле (5) где ρ - давление окружающего воздуха во время отбора
пробы, кПа; θ - температура
окружающего воздуха во время отбора пробы, °С. Отбираемый воздух может содержать
соединения, которые дадут хроматографические пики в условиях, выбранных для
анализа на ВЭЖХ. Например, кроме изоцианатов в пробе нередко содержатся
ароматические амины. Способ идентификации с использованием отношения сигналов
детекторов, описанный выше, детектирование с использованием диодной матрицы, и,
при необходимости, использование инфракрасного детектора с
Фурье-преобразованием или масс-спектрометриметрического детектора позволяют
точно идентифицировать аналит. Если мешающие вещества точно или предположительно
известны, то аналитику должна быть передана информация об их природе. Результат измерения массовой
концентрации изоцианатов в воздухе рабочей зоны должен сопровождаться
соответствующей оценкой его неопределенности, выраженной как расширенная
неопределенность [5]
и [17].
Таким образом, оценка неопределенности должна проводиться в соответствии с
одним из этих определений неопределенности. В обоих случаях оценка представляет
собой определение вкладов в неопределенность, оцененных в лаборатории и на
основе смодулированных испытаний в условиях применения или на основе
существующей информации. Полученные значения неопределенности измерения следует
сравнить с показателями, установленными, например, в [17],
либо показателями, установленными в национальных или международных
законодательных актах. Примечание - Вычисления основаны на методике расчета, используемой в [2]. 11.1.1 Краткое
изложение методики расчета В методике расчета с
использованием «бюджета неопределенности» суммируют вклады каждого
индивидуального источника неопределенности аналитического метода. Для
результатов измерений массовой концентрации изоцианатов в воздухе рабочей зоны
методом, установленным настоящим стандартом, квадрат суммарной неопределенности
ис вычисляют по формуле (6) где uVsam -
неопределенность объема пробы; uρsam -
неопределенность массовой концентрации изоцианатов в реальной пробе; uρblank -
неопределенность массовой концентрации изоцианатов в холостой пробе; ubL - межлабораторная неопределенность. Полный анализ этих составляющих
неопределенности приведен в [5]
и [17],
а также в 11.2
- 11.7. Данная
методика была также использована при вычислении неопределенности измерений для Desmodur N 3390®,
соединения на основе HDI с использованием
ранее полученных данных [9].
Перечень данных, использованных для вычисления суммарной и расширенной
неопределенностей, приведен в таблице В.1 приложения
В. Значения неопределенности, полученные для каждого уровня
содержания введенного соединения, приведены в таблице
С.1 приложения
С. 11.1.2 Результаты
расчета неопределенности При объединении данных,
полученных для определяемых соединений, была получена суммарная
неопределенность 27 % (для семи соединений, четырех уровней концентраций, двух
типов устройств отбора проб). Соответствующая расширенная
неопределенность (удвоенное значение суммарной неопределенности) составила 54
%. Значительной разницы в
результатах измерений, полученных с использованием комбинации импинжер - фильтр
и с использованием одного фильтра не наблюдалось. Расширенные неопределенности
для некоторых конкретных соединений приведены в таблице 3. Таблица 3 - Расширенные неопределенности для некоторых
конкретных соединений Соединениеa) Расширенная
неопределенность, % наилучший
случай наихудший
случай Desmodur H 43 60 Suprasec 5030 48 77 Suprasec 2234 42 80 Aldrich 415806 43 65 Desmodur N 3300 47 87 Desmodur T80 47 50 Desmodur N 3390 46 72 a) Соединения Desmodur, Suprasec и Aldrich являются примерами продукции,
выпускаемой серийно. Данная информация приведена для удобства пользователей
настоящего стандарта и не является рекламой данной продукции со стороны ИСО. 11.2.1 Эффективность
улавливания в зависимости от распределения частиц по размеру Подробное описание требований и
методов определения данной характеристики приведено в [18]. 11.2.2 Объем отобранного
воздуха Отобранный объем воздуха Vsam, л, вычисляют по формуле (см. [19]) (7) где q0 - расход в начале периода отбора пробы, л/мин; qe - расход в конце периода отбора пробы, л/мин; t - продолжительность отбора пробы, мин. Неопределенность результатов измерения объема
отобранного воздуха вычисляют по формуле (8) в которой первый член
представляет собой неопределенность измерений расхода до и в конце периода
отбора проб, второй член - неопределенность измерений времени отбора проб, третий
член - неопределенность, связанную с изменениями расхода во время периода
отбора проб. 11.2.3 Время отбора
проб Время отбора проб t может быть измерено с погрешностью в пределах ± 0,1
мин. Для продолжительности отбора проб 8 ч относительной неопределенностью
измерений t можно пренебречь, т.е. на практике второй член в
формуле (8) может быть принят равным 0. 11.2.4 Изменения
расхода во время отбора проб Расход во время отбора проб неизвестен.
Квадрат неопределенности (см. [5]),
обусловленной изменениями расхода во время отбора проб, может быть оценен на
основе (9) 11.2.5 Приведение
значений массовой концентрации к заданным температуре и давлению Для приведения значений массовой
концентрации к заданным температуре и давлению необходимо знать действительные
средние значения температуры и давления во время отбора проб. Значения
квадратов неопределенностей, обусловленных характеристиками средств измерений
температуры 9 и давления р, используемых для приведения к заданным условиям,
могут быть получены на основе результатов реальных измерений с учетом
неопределенности, обусловленной градуировкой датчиков температуры и давления,
по формуле (10) где ucal - неопределенность, обусловленная градуировкой
датчиков температуры или давления; smeas - стандартное отклонение окончательных результатов
измерений температуры или давления; n - число результатов измерений температуры или давления. Также необходимо знать предельные значения температуры
и давления во время отбора проб, предполагая их нормальное распределение.
Например, квадрат неопределенности, обусловленной температурой, вычисляют по
формуле (11) где θmax и θmin - предельные
значения температуры. Обычно первый член в формуле
является незначительным по сравнению со вторым. 11.2.6 Суммарная
неопределенность объема пробы Приведенные выше вклады в неопределенность
суммируют, и неопределенность объема пробы, приведенного к заданным условиям,
вычисляют по формуле (12) 11.3.1 Масса аналита
в пробе Массу аналита в пробе воздуха msam вычисляют по формуле (13) где muc - масса аналита в пробе без учета поправки; Еcoll - эффективность улавливания; vs - нестабильность устройства отбора проб; Sanal - стабильность аналита в пробе; Еr/е - эффективность реакции/экстракции. Стабильность аналита Sanal должна быть установлена экспериментально для
условий хранения (время, температура, окружающие условия), типичных для
конкретной лаборатории. Испытания необходимо проводить при уровне содержания
аналита, соответствующем концентрации эквивалентной предельно допустимому
значению. При времени t = 0 и t = t должен быть проанализирован ряд проб (n ≥ 6)в условиях повторяемости. Данные моменты времени
пробы следует выбирать случайным образом из партии репрезентативных проб, чтобы
свести к минимуму возможные систематические изменения массовой концентрации.
Для проверки стабильности используют t-критерий Стьюдента (двусторонний критерий, при уровне доверительной
вероятности 95 %). Неопределенность определения стабильности состоит из
вкладов, обусловленных: a) десорбцией
(случайная составляющая эффективности десорбции); b) градуировкой
(случайная составляющая градуировки); c) прецизионностью, относящейся
к аналитической процедуре; d) неоднородностью
партии проб. По существу вклад в
неопределенность, обусловленный определением стабильности аналита, уже включен
в другие вклады в неопределенность и нет необходимости его учитывать. 11.3.3 Эффективность
реакции/экстракции Эффективность реакции/экстракции
соединений Еr/е и ее
неопределенность обычно получают на основе повторных измерений аттестованных
образцов сравнения соединения или продукта(ов) его реакции. Неопределенность,
обусловленную неполнотой реакции/экстракции для уровня содержания соединения,
соответствующего предельно допустимому значению, вычисляют по формуле (14) где UmCRM -
неопределенность аттестованной массы соединения в аттестованном образце
сравнения; mCRM - аттестованная масса соединения в аттестованном
образце сравнения; Последним членом в формуле (14),
представляющим собой неопределенность, обусловленную систематическим смещением
значения измеренной массы от аттестованного значения, можно пренебречь, если
смещение является статистически незначимым при уровне доверительной вероятности
95 %. Если смещение является статистически значимым при уровне доверительной
вероятности 95 %, то вводят поправку. Если аттестованного образца
сравнения нет в наличии, то следует использовать материал наивысшего
метрологического качества. 11.3.4 Неисправленная
масса аналита Неопределенность неисправленной
массы аналита обусловлена: a) неопределенностью
массовой концентрации соединения в используемых градуировочных стандартных
образцах; b) несоответствием
градуировочного графика; c) дрейфом выходного
сигнала детектора между градуировками; d) прецизионностью
анализа; e) селективностью
хроматографической системы. 11.3.5 Градуировочные стандартные образцы Неопределенность массовой
концентрации соединения в используемых градуировочных стандартных образцах
будет зависеть от типа градуировочного стандарта. Для градуировочных
стандартных образцов, состоящих из растворов стандартных образцов в толуоле или
ацетонитриле, неопределенность будет складываться из следующих вкладов. 11.3.5.1 Чистота
изоцианата, известная из сопроводительной документации производителя, обычно
приводится как минимальный уровень чистоты w, выраженный в процентах массовой доли, заданный
определенным числом либо границей интервала, т.е. w = 99 % или w ≥ 99 %. Если w = 99 %, то относительная неопределенность, обусловленная наличием
примесей, задается как (100 - w) %; если w ≥ 99 %, то относительную неопределенность можно
оценить, полагая наличие равномерного распределения, по формуле (15) 11.3.5.2 Неопределенности
взвешиваний веществ и растворов, т.е. погрешность используемых весов. При
получении результатов по разности взвешиваний вклад неопределенности
результатов взвешивания обычно вычисляют по формуле (16) где ubal - погрешность
используемых весов. 11.3.6 Несоответствие градуировочной функции Неопределенность, обусловленную
несоответствием градуировочной функции uL0F, вычисляют для соответствующей массовой концентрации
(соответствующей массе аналита, отобранной при предельном значении
концентрации) на основе относительных разностей для градуировочной функции,
полученной методом линейной регрессии с наименьшими квадратами, взвешенными по
концентрации аналита в градуировочном стандартном образце, по формуле (17) где mregr - масса аналита,
вычисленная по уравнению линейной регрессии, при уровне концентрации
градуировочного стандартного образца, наиболее точно соответствующей массе
аналита в пробе при предельном значении концентрации; mstd - масса аналита, присутствующего в соответствующем
градуировочном стандартном образце; Rrel - относительная
разность для заданного уровня массовой концентрации. Примечание - Несоответствие градуировочной функции будет вносить вклад в неопределенность,
обусловленную неполнотой экстракции или реакции, если эффективность
реакции/экстракции значительно отличается от 1. В этом случае независимо от
того, была ли введена поправка на неполноту реакции/экстракции,
неопределенность, обусловленная несоответствием градуировочной функции, не
нужно учитывать при оценке неопределенности. 11.3.7 Дрейф выходного сигнала детектора Неопределенность, обусловленная
дрейфом выходного сигнала детектора, udrift можно оценить
на основе относительных разностей выходных сигналов между последовательными
градуировками по формуле (18) где rn - выходной сигнал детектора r, при n-м анализе градуировочного стандартного образца, наиболее
точно соответствующем массе соединения при его предельном содержании в пробе; rn-1 - выходной сигнал детектора r при предыдущем
(n-1)-м анализе
градуировочного стандартного образца, наиболее точно соответствующем массе
соединения при его предельном содержании в пробе. 11.3.8 Прецизионность
анализа Неопределенность, обусловленная
недостаточной прецизионностью анализа, ur определяют проведением анализа градуировочных
стандартных образцов одного и того же состава в условиях повторяемости.
Необходимо провести не менее шести повторных анализов. Неопределенность
вычисляют по формуле (19) где sanal - стандартное
отклонение выходных сигналов при повторных анализах; При оценке неопределенности
данный вклад уже включен во вклады в неопределенность при определении
эффективности десорбции и нет необходимости его учитывать. Используемая система разделения
(колонка для ВЭЖХ, градиентная программа) должна быть оптимизирована для
сведения к минимуму неопределенности, обусловленной (незамеченным) совместным
элюированием потенциальных мешающих веществ. Разрешение используемой ВЭЖХ
системы R вычисляют по формуле (20) где ∆tr - разность времени удерживания аналита и мешающего
вещества, с; banal - ширина пика
аналита на полувысоте, с; bj - ширина пика мешающего вещества на полувысоте, с. Для соответствия требованиям
настоящего стандарта R должно быть меньше 1. В этом случае максимальная
неопределенность, обусловленная совместным элюированием, составляет 2,5 %.
Типичный вклад в неопределенность составит ± 0,7 %. 11.3.10 Суммарная
неопределенность измерения массы аналита Приведенные выше вклады в
неопределенность объединяют и неопределенность измерения массы аналита umanal (исключая неопределенность, обусловленную
недостаточной прецизионностью) вычисляют по формуле (21) где ucstd - неопределенность
массовой концентрации градуировочных стандартных образцов (см. 11.3.5); uL0F- неопределенность, обусловленная несоответствием
градуировочной функции (см. 11.3.6); udrift - неопределенность,
обусловленная дрейфом выходного сигнала детектора (см. 11.3.7); usel - неопределенность селективности анализа (см. 11.3.9). 11.3.11 Суммарная
неопределенность измерения массы аналита в пробе Вклады в неопределенность,
приведенные в 11.3.2-11.3.9,
объединяют и неопределенность измерения массы аналита в пробе воздуха вычисляют
по формуле (22) Массу аналита в холостой пробе,
отобранной в условиях применения, mblank определяют
проведением анализа ряда холостых проб в условиях повторяемости; необходимо
провести не менее шести повторных анализов. Неопределенность вычисляют с
использованием градуировочной функции, экстраполированной в точку,
соответствующую уровню показаний холостой пробы, по формуле (23) где sblank - стандартное отклонение
результатов повторных анализов холостых проб; bblank - угловой коэффициент градуировочного графика,
экстраполированного к уровню холостых показаний в условиях применения. Если показание холостого опыта в три раза меньше уровня
шумов детектора при времени удерживания аналита, то уровень холостых показаний
и его неопределенность следует вычислять на основе уровня шумов детектора с
использованием градуировочной функции при нулевом выходном сигнале, в
предположении о его нормальном распределении, по формулам: (24) (25) где r0 - уровень шумов; b0 - угловой коэффициент градуировочной функции при
нулевом выходном сигнале. Разные лаборатории могут не
ограничиваться процедурами, приведенными выше, а использовать различные
подходы. Окончательные дополнительные вклады в неопределенность можно
определить количественно проведением межлабораторных сличений, полностью
охватывающих методику выполнения измерений, включая отбор и анализ проб.
Межлабораторные сличения должны быть организованы в соответствии с ИСО 5725-2 с
использованием выборок достаточной однородности для обеспечения того, чтобы
вклад в межлабораторную неопределенность, обусловленный неоднородностью, был
незначительным. Если на практике эта неопределенность составляет < 2 %, то
ее считают удовлетворительной. Суммарную неопределенность
измерения массовой концентрации аналита в пробе воздуха ucsam получают
объединением вкладов в неопределенность, вычисленных по формулам (12), (22)
и (23) или (25), при необходимости
прибавляя межлабораторную неопределенность, по формуле (26) где ubL -
межлабораторный вклад в неопределенность. Расширенную неопределенность ρsam для уровня
доверительной вероятности 95 % получают умножением uρsam на коэффициент охвата 2. Установлено, что изоцианатные производные мочевины
(MP-производные)
остаются стабильными в течение нескольких лет при хранении в морозильной камере.
Данные по стабильности фильтров и растворов (на основе толуола и ацетонитрила)
приведены в 5.5. Протокол
измерений должен содержать, по крайней мере, следующую информацию: a) полную идентификацию пробы; b) ссылку на настоящий стандарт или другой
дополнительный стандарт; c) место и продолжительность отбора проб, объем
отобранного воздуха; d) атмосферное давление и температуру (при
необходимости); e) результат(ы) измерения; f) любые необычные обстоятельства, замеченные
во время анализа; g) любые действия, не включенные в настоящий
или ссылочные международные стандарты или рассматриваемые как необязательные. При
использовании настоящего стандарта уровень контроля качества результатов
измерений должен быть соответствующим. Настоятельно рекомендуется всем
лабораториям, проводящим определение содержания опасных веществ в воздухе
рабочей зоны, принимать участие в программе внешней оценки качества результатов
измерений (например, WASP 1) [1]). 1) WASP - Workplace Analysis
Scheme for Proficiency. А.1 Получение стандартной
паровоздушной смеси При использовании только импинжера эффективность
отбора проб (ЭО) для каждого определяемого изоцианата следует определять в
диапазоне значений массовой концентрации, характерном для пробы. Для того,
чтобы отобрать изоцианаты с соответствующей массовой концентрацией,
температурой и влажностью при необходимом времени отбора пробы и расходе, можно
использовать генератор стандартных паровоздушных смесей. С полученными для
определения ЭО пробами обращаются так же, как с реальными пробами (см. выше).
ЭО равна частному от деления массы (в миллиграммах), извлеченной из импинжера,
на введенную массу (в миллиграммах). Если ЭО в условиях отбора проб менее 0,75
(75 %), то результат считают недействительным. А.2 Трудности при получении
паровоздушных смесей Для форполимеров изоцианатов использование
генератора паровоздушных смесей практически невыполнимо, так как эти соединения
в большинстве содержатся в виде смесей взвешенных частиц и паров при
представляющих интерес концентрациях. Также трудно точно приготовить стабильную
стандартную паровоздушную смесь для мономеров. Обычно полученные значения
массовой концентрации ниже расчетных значений на 20 %-30 % из-за адсорбции
мономеров на поверхности аппаратуры, поэтому для большинства измерительных
задач считают ЭО равной 1,0 как для мономеров, так и для полимеров. Таблица В.1 - Оценка
неопределенности Изоцианат а) Desmodur Suprasec 5030 Suprasec 2234 Desmodur Aldrich 415806 Desmodur T80 Desmodur Неопределенность
объема пробы Объем пробы 5
% - наихудший результат измерения Градуировка
расходомера В
метрологических характеристиках HSL 1) для
расходомеров приведен допуск ± 8 (внутренняя процедура HSL 1) SCP 2)-001);
погрешность расходомеров, используемых для контроля расхода насосов, не
выходила за пределы данного допуска; значение 8 было принято за наихудший
случай Разброс расходомера Время отбора
проб 15
мин (импинжер/фильтр) или 8 мин (фильтр) ± 6 с по секундомеру, получается
неопределенность 1 % (фильтр) или 0,5 % (импинжер/фильтр) Температура 1
% - оцененная Давление 1
% - оцененная Неопределенность
определенной массы аналита Масса
аналита Определена
с использованием значений относительного стандартного отклонения (RSD 3)) в процентах [7] [9] Стабильность Стандартные
образцы твердых MP-производных
стабильны не менее 10 лет. 1
% для растворов (определено во время процедур градуировки HSL, ~ 6 месяцев). 9
% для фильтров (27 дней) [9]. Эффективность
реакции/экстракции Определена
с использованием значений эффективности извлечения в процентах [7] [9] Масса
изоцианата в градуировочных стандартных образцах 0,1
% для метрологических характеристик весов (внутренняя процедура HSL1) SCP2)-002);
стандартные образцы, используемые при анализе, обычно имеют чистоту более 99
% Несоответствие
градуировочного графика 5
% - наихудшее значение для ЭХД Дрейф 5
% - наихудшее значение; новую градуировку проводят для каждой серии проб, для
проверки градуировки анализируют контрольные пробы после каждых 10 проб или
каждые 4 ч Прецизионность 12
% - рассчитано по данным HSL WASP4); шесть лаборантов-аналитиков, 2 системы ВЭЖХ: 29
циклов, 4 фильтра с MDI за цикл Селективность
хроматографии Незначительна
- процедуры идентификации пиков см. [1] Неопределенность
холостого значения Холостой
опыт Незначительно
- 10σ при
определении массовой концентрации изоцианата в холостом опыте составили (для n = 6)
приблизительно 0,004 мкг/л Неопределенность
при проведении межлабораторных сличений Межлабораторные
сличения 12
% - рассчитано по данным WASP4) (все
лаборатории-участники), 19 лабораторий/27 циклов а)
Соединения Desmodur, Suprasec и Aldrich являются примерами продукции, выпускаемой
серийно. Данная информация приведена для удобства пользователей настоящего
стандарта и не является рекламой данной продукции со стороны ИСО. 1) HSL -
Health and Safety Laboratory. 2) SCP - Standard Control
Procedure. 3) RSD -
Relative Standard Deviation. 4) WASP -
Workplace Analysis Scheme for Proficiency. Таблица С.1 - Вычисленные суммарные неопределенности для
конкретных изоцианатов Изоцианат а) Устройство
отбора проб Содержание
соединения во вводимом растворе Суммарная
неопределенность Расширенная
неопределенность Desmodur H Импинжер
плюс фильтр 2 23,8 47,7 1 26,9 53,8 0,5 21,4 42,8 0,1 28,1 56,1 Фильтр 2 24,9 49,8 1 27,9 55,8 0,5 23,4 46,8 0,1 30,1 60,3 Suprasec 5030 Импинжер
плюс фильтр 2 29,0 58,0 1 38,6 77,2 0,5 38,0 76,0 0,1 26,3 52,6 Фильтр 2 24,0 48,0 1 24,9 49,7 0,5 24,7 49,5 0,1 33,1 66,3 Suprasec 2234 Импинжер
плюс фильтр 2 21,1 42,2 1 22,5 44,9 0,5 21,5 42,9 0,1 26,3 52,6 Фильтр 2 29,7 59,5 1 27,5 55,0 0,5 29,3 58,6 0,1 39,8 79,6 Desmodur N3300 Импинжер
плюс фильтр 2 31,7 63,5 1 27,7 55,5 0,5 23,6 47,3 0,1 43,5 87,1 Фильтр 2 30,6 61,2 1 29,1 58,1 0,5 25,7 51,4 0,1 27,2 54,4 Aldrich 415806 Импинжер
плюс фильтр 2 23,6 47,3 1 21,6 43,3 0,5 30,9 61,7 0,1 27,1 54,3 Фильтр 2 24,0 48,0 1 25,3 50,7 0,5 26,0 52,0 0,1 32,5 65,0 Desmodur T80 Импинжер
плюс фильтр 2 24,3 48,5 1 23,6 47,2 0,5 24,1 48,2 0,1 25,2 50,4 Фильтр 2 23,3 46,6 1 24,0 48,0 0,5 23,9 47,9 0,1 24,0 48,0 Desmodur N3390 Импинжер
плюс фильтр 2 23,0 46,1 1 24,4 48,8 0,5 29,0 58,0 0,1 36,0 72,0 Фильтр 2 24,2 48,4 1 27,1 54,1 0,5 27,7 53,4 0,1 27,6 55,2 a) Соединения Desmodur, Suprasec и Aldrich являются примерами продукции,
выпускаемой серийно. Данная информация приведена для удобства пользователей
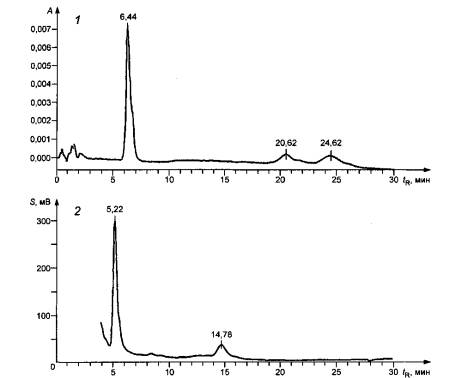
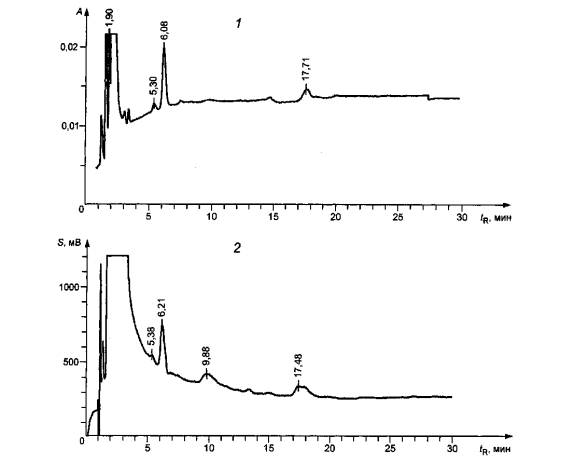
настоящего стандарта и не является рекламой данной продукции со стороны ИСО. 1 - хроматограмма, полученная на УВИД; 2 - хроматограмма, полученная на
ЭХД; А - УФ-поглощение при
длине волны 242 нм; S - сигнал ЭХД; tR - время
удерживания Рисунок D.1 -Хроматограммы для полимеров HDI (Desmodur N 3300), полученные на ЭХД и УВИД Хроматограмма на ЭХД (2) представляет собой
результат анализа раствора изоцианатов с массовой концентрацией приблизительно
0,5 мкг/мл. Хроматограмма на УВИД (1) была
получена в условиях более медленного хроматографирования для пробы с более
высокой массовой концентрацией изоцианатов (приблизительно 5 мкг/мл), чтобы
получить чистый УФ-спектр для облегчения идентификации пиков соответствующих
изоциана-там и другим соединениям (см. рисунок D.2). 1,2 - изоцианаты (tR = 6,44 и 20,62 соответственно); 3 - другое
соединение, (tR = 24,62); А, - длина волны; tR - время удерживания Рисунок D.2 - Участок УФ-спектра для полимеров HDI (Desmodur N 3300) 1 - хроматограмма полученная на УВИД; 2 - хроматограмма полученная на
ЭХД; А - УФ-поглощение при длине волны 242 нм; S - сигнал ЭХД; tR - время удерживания Рисунок D.3 - Хроматограммы для полимеров MDI (Suprasec 5030),
полученные на УВИД и ЭХД Хроматограмма на ЭХД (2) была получена для раствора
изоцианатов с массовой концентрацией приблизительно 0,5 мкг/мл. Хроматограмма
на УВИД (7) была получена при тех же условиях хроматографирования для пробы с
более высокой массовой концентрацией изоцианатов (приблизительно 50 мкг/мл),
чтобы получить чистый УФ-спектр для облегчения идентификации пиков,
соответствующих изоцианатам и другим соединениям (см. рисунок D.4). Идентификацию проводили путем сличения с
библиотекой УФ-спектров (по «форме» пиков, полученных на УВИД) и последующего
вычисления отношения сигналов ЭХД/УВИД. ЭХД устанавливают после УВИД, поэтому
пики на ЭХД появляются немного позже, чем соответствующие пики на УВИД. 1,3, 6, 8, 10,14,15 - другие соединения (tR = 3,14; 4,79;
6,58; 8,18; 9,26; 14,42 и 16,50 мин соответственно); 2,4 - MDI-мономеры (tR
= 4,08 и 5,42 мин соответственно); 5, 7, 9, 11,12, 13 - изоцианаты (tR
= 5,88; 7,48; 8,78; 10,28; 10,85 и 13,21 мин соответственно); γ - длина
волны; tR - время удерживания Рисунок D.4 - Участок УФ-спектра для полимеров MDI (Suprasec 5030) 1 - хроматограмма полученная на УВИД; 2 - хроматограмма полученная на
ЭХД; А - УФ-поглощение при длине волны 242 нм; S - сигнал ЭХД; tR - время удерживания Рисунок D.5 - Хроматограммы для полимеров
2,4-TDI (Aldrich # 415806), полученные на УВИД и ЭХД Хроматограмма на ЭХД (2) представляет собой
результат анализа раствора изоцианатов с массовой концентрацией приблизительно
0,5 мкг/мл. Хроматограмма на УВИД (1) была
получена при тех же условиях хрома-тографирования для пробы с более высокой
массовой концентрацией изоцианатов (приблизительно 5 мкг/мл), чтобы получить
чистый УФ-спектр для облегчения идентификации пиков соответствующих изоцианатам
и другим соединениям (см. рисунок D.6). Идентификацию проводили так же, как описано для рисунка D.3. 1 - ацетилированный MP (tR = 1,90 мин); 2 - изоцианат (tR = 5,30 мин); 3 - изоцианат (tR = 6,08 мин); 4 - другие соединения (tR = 17,71 мин); γ - длина волны; tR - время удерживания Рисунок D.6 - Участок УФ-спектра для полимеров 2,4-TDI (Aldrich 415806) Таблица Е.1 Обозначение
ссылочного международного стандарта Обозначение и
наименование соответствующего национального стандарта Российской Федерации ИСО 5725-2:1994 ГОСТ
Р ИСО 5725-2-2002 Точность (правильность и прецизионность) методов и
результатов измерений. Часть 2. Основной метод определения повторяемости и
воспроизводимости стандартного метода измерений ЕН 1232:1992 * *
Соответствующий национальный стандарт отсутствует. До его утверждения рекомендуется
использовать перевод на русский язык данного международного стандарта.
Перевод данного международного стандарта находится в Федеральном
информационном фонде технических регламентов и стандартов. MDHS 25/3 Organic isocyanates in air - Laboratory method using
sampling either onto 1-(2-methoxyphenyl)piperazine coated glass fibre filters
followed by solvent desorption or into impingers and analysis using high
performance liquid chromatography. Health and Safety Executive Books,
Sudburv, 1999. Available at: www.hse.qov.uk/pubns/mdhs/pdfs/mdhs25-3.pdf [cited 2007-11-13]
©Crown copyright, 1999 Determination of organonitrogen compounds in air using liquid
chromatography and mass spectrometry - Part 2: Amines and aminoisocyanates
using dibutylamine and ethyl chloroformate Henriks-Eckerman, M.-L, Valimaa, J., Rosenberg C. Determination of
airborne methyl isocyanate as dibutylamine or 1-(2-methoxyphebyl)piperazine
derivatives by liquid and gas chromatography. Analyst, 2000, 125, p. 1949-54 Vangronsveld, E., Mandel, F. Workplace monitoring of isocyanates using
ion trap liquid chromatography/tandem mass spectrometry. Rapid Commun. Mass
Spectrom., 2003,17, p. 1685-90 Guide to the expression of uncertainty in measurement.
BIPM/IEC/IFCC/ISO/IUPAC/IUPAP/OIML White, J. Isocyanate call-off contract, Health and Safety Laboratory
internal report OMS/2003/12,2003 White, J. International Organization for Standardization,
Intercomparison of methods for isocyanates in Air, Phase 1, Results for MDHS
25/3, Health and Safety Laboratory internal report OMS/2004/07,2004 Robertson S. The stability of isocyanate derivatives in the MDHS 25
method, Health and Safety Laboratory internal report, IR/L/AO/83/17, 1983 White J. Evaluation of MDHS 25/2: The determination of isocyanates in
a reacting paint mix, Health and Safety Laboratory internal report, IACS
97/19, 1997 MDHS 14/3. General methods for the gravimetric
determination of respirable and total inhalable dust. Health and Safety
Executive Books, Brown, R.H., Monteith, L.E. Gas and vapour
sample collectors. In: Cohen, B.S., Hering, S.V., editors. Air sampling
instruments, 8th edition, pp. 369-400. ACGIH, Levine S.P., Hillig K.J.D., Dharmarajan V.,
Spence M.W., Baker M.D. Critical review of methods for sampling, analysis,
and monitoring of TDI. Hext, P.M., Booth, K., Dharmarajan, V.,
Karoly, W.J., Parekh, P.P., Spence, M. A comparison of the sampling
efficiency of a range of atmospheric samplers when collecting polymeric MDI
aerosols, Appl. Occup. Environ. Hyg. 2003, 18(5), pp. 346-56 White J., Evans S.G., Patel S., Brown R.H.
Development of MDHS 25/2: Organic isocyanates in air. Health and Safety Laboratory internal
report IACS 97/2, 1997 [15] White J., Brown R.H., Clench M.R. Particle
beam liquid chromatography: Mass spectrometry analysis of hazardous
agricultural and industrial chemicals, Rapid Commun. Mass Spectrom. 1997, 11,
pp. 618-23 [16] White, J. MDHS 25 revisited: Development of
MDHS 25/3, the determination of organic isocyanates in air, Ann. Occup. Hyg.
2006, 50(1), p. 15-27 [17] EN 482 Workplace atmospheres - General requirements
for the performance of procedures for the measurement of chemical agents [18] ISO 16200-1 Workplace air quality - Sampling and analysis
of volatile organic compounds by solvent desorption/gas chromatography - Part
1: Pumped sampling method [19] EN 13205 Workplace atmospheres - Assessment of
performance of instruments for measurement of airborne particle concentrations [20] ISO 6145 (all parts) Gas analysis - Preparation of calibration gas
mixtures using dynamic volumetric methods Ключевые
слова: воздух, рабочая
зона, качество, взвешенные частицы, изоцианаты, проба, отбор, анализ, жидкостная
хроматография, ультрафиолетовый детектор, электрохимический детектор
Вернуться в "Каталог СНиП"
Источник информации: https://internet-law.ru/stroyka/text/55822
На эту страницу сайта можно сделать ссылку:
На правах рекламы: |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
© Антон Серго, 1998-2024.
|
Разработка сайта |
|